منیزیم (به انگلیسی: Magnesium) فلزی است به رنگ سفید یا نقرهای با نشان شیمیایی Mg، عدد اتمی ۱۲ و جرم اتمی ۲۴٫۳۰۵۰ است. ساختار بلور آن ششگوش یا هگزاگونال متراکم است. نام منیزیم از واژهٔ یونانی Magnesia حوضهای در Thessaly یا از نام شهر قدیمی Magnesia در آسیای صغیر گرفته شدهاست. هشتمین عنصر فراوان در پوسته زمین، سومین عنصر فراوان و محلول در آب دریا و یازدهمین عنصر فراوان در بدن انسان است. منیزیم در گروه ۲ جدول تناوبی به عنوان فلز قلیایی خاکی قرار دارد.
ویژگیها
منیزیم به عنوان سبکترین فلز صنعتی با ویژگیهای منحصر به فرد متالورژیکی، کاربردهای وسیعی در صنایع مختلف یافتهاست. علیرغم وجود محدودیتهای ذاتی در تولید و استفاده از منیزیم به دلیل این ویژگیها روزبهروز به کاربرد این فلز در صنایع مختلف افزوده میشود.[۲] میتوان از ویژگیهای منحصر به فرد منیزیم موارد زیر را برشمرد:
- منیزیم با چگالی ۱٫۷ گرم بر سانتیمتر مکعب، سبکترین فلز با قابلیت تولید قطعات صنعتی است. چگالی منیزیم ۳۰ درصد از آلومینیوم کمتر (چگالی آلومینیوم ۲٫۷ گرم بر سانتیمتر مکعب) و تنها ۲۰ درصد چگالی آهن است (چگالی آهن ۷٫۸ گرم بر سانتیمتر مکعب است). این ویژگی منحصر به فرد جذابیت فراوانی برای استفاده از این فلز در تولید قطعات متحرک و صنعت حمل و نقل ایجاد کردهاست.
- علاوه بر چگالی پایین، آلیاژهای منیزیم استحکام قابل توجهی از خود نشان میدهند. این ویژگی سبب افزایش نسبت استحکام به وزن این فلز شدهاست. به عنوان مثال جهت تغییر جنس تیری ۱۰ کیلویی از فولاد، میتوان بدون تغییر چقرمگی از تیری منیزیمی با وزن ۳٫۸ کیلوگرم استفاده کرد. نسبت بالای استحکام به وزن سبب شده در بسیاری از قطعات مختلف صنایع هوایی و خودروسازی از منیزیم استفاده شود. نمونه چنین قطعاتی پوسته جعبه دنده بالگرد است.
- از ویژگیهای دیگر آلیاژهای منیزیم میتوان به قابلیت جذب ارتعاشات توسط این فلز اشاره کرد. این ویژگی سبب شدهاستفاده از آلیاژهای منیزیم برای مدیریت ارتعاشات مخصوصاً در صنعت خودرو بسیار مورد توجه قرار گیرد. در مقایسه با آلیاژ آلومینیوم A356 با ضریب میرایی ۱٪ در تنش ۱ مگا پاسکال، برای آلیاژ AZ91 منیزیم این ضریب ۲۵٪ است. در تنش ۱۰۰ مگا پاسکال این ضریب برای آلومینیوم A356 %4 و برای منیزیم AZ91 %54 است.
- علاوه بر قابلیت میرایی ارتعاشات، منیزیم سپری قوی در برابر امواج الکترو مغناطیس نیز است. دیوارهای ۱ میلیمتری از منیزیم به راحتی میتواند امواجی با شدتهای بالاتر از ۸۵ دسی بل را سد کند. از این ویژگی منیزیم برای تولید بدنه تلفنهای همراه، تجهیزات الکترونیکی، نظامی و تولید سیمهای انتقال اطلاعات پرتوان استفاده میشود.
- یکی دیگر از خصوصیات آلیاژهای منیزیم در مقایسه با آلومینیوم پایداری ابعادی در برابر تغییرات حرارتی است. در منیزیم، پارامترهای مختلف خواص حرارتی،مانند رسانایی پایینتر و گرمای ویژه بالاتر از آلومینیوم است. از جمله فرایندهای تحت تأثیر خواص حرارتی ماشین کاری دقیق است. آلیاژهای منیزیم حین گرم و سرد شدن سریع در فرایند ماشین کاری، تغییرات ابعادی کمی دارند. این ویژگی ماشین کاری دقیق این آلیاژها را سادهتر میسازد.
- منیزیم در مقایسه با آلومینیوم، سیالیت بالا در ریختهگری، نیاز به فشار کمتر در دایکست و عدم واکنش با فولاد در بوته و قالب است. با در نظر گرفتن این مزایا میتوان برای دایکست قطعهای منیزیمی از دستگاههای دایکست با ظرفیت کمتر استفاده نموده و تعداد به مراتب بیشتری قطعه در قالبهای مشابه فولادی تولید کرد.
محدودیتها
با وجود ویژگیهای منحصر به فرد و خاص آلیاژهای منیزیم، این آلیاژها محدودیتهای ذاتی به همراه دارند که استفاده از آنها را محدود ساختهاست.[۲] دانشمندان در تلاشند که با طراحی آلیاژهای جدید و فرایندهای تولید نوآورانه بر این محدودیتها فائق آیند. افزایش مصرف روزافزون آلیاژهای منیزیم نشان از موفقیت دانشمندان در توسعه کاربرد آلیاژهای منیزیم و چیره شدن مزیتها بر محدودیتهای این آلیاژها دارد. بهطور کلی میتوان محدودیتهای آلیاژهای منیزیم را در سه دسته طبقهبندی کرد:
۱_ ناهمسانگردی خواص مکانیکی، منیزیم با ساختار هگزاگونال از تقارن پایینی در مقیاس بلوری برخوردار است. چینش خاص صفحات بلوری در ساختار هگزاگونال سبب شده در صفحاتی خاص تراکم شبکه به مراتب از صفحات دیگر بالاتر باشد. این تفاوت تأثیر مستقیمی بر قابلیت حرکت نابجاییها در جهات مختلف میگذارد. به صورتی که در برخی صفحات و جهات (صفحات قاعدهای) نابجاییها به راحتی و با تنش برشی پایین قابلیت حرکت پیدا میکنند، درحالی که در سایر صفحات (مانند صفحات منشوری و هرمی) قابلیت حرکت نابجاییها به شدت محدود است. این نا یکنواختی سبب محدودیتهایی در تغییر شکل میشود. در اثر حرکت نابجاییها شبکه کریستالی داخل دانهها به سوی جهت اعمال نیرو چرخش میکند. در آلیاژهای منیزیم به دلیل حرکت اکثر نابجاییها در صفحات قاعدهای، چرخش کریستالی اکثر دانهها به سمت جهتی واحد خواهد بود (صفحه نرمال قاعدهها به سوی جهت اعمال نیرو میگردد). در نتیجه پس از تغییر شکل ماده، پلی کریستال حاوی دانههایی خواهد بود که همگی با هم، هم راستا شدهاند و ناهمسانگردی ساختار هگزاگونال داخل خود را به کل قطعه تعمیم دادهاند. به عنوان مثال ورقی از آلیاژ منیزیم با چنین جهتگیری بلوری حین کشش عمیق به راحتی در راستای صفحه نابجاییها حرکت کرده و تغییر شکل میدهد. اما تغییر شکل در ضخامت ورق که وابسته به حرکت نابجاییها در صفحات منشوری و هرمی است بسیار محدود بوده و لذا تغییر شکل در این راستا ممکن نبوده و ورق به سرعت پاره میشود. در شکل انتهای صفحه سیستمهای لغزش و سیستمهای دوقلویی ساختار هگزاگونال منیزیم قابل مشاهده است. علیرغم چنین محدودیت ذاتی، دانشمندان روشهای مختلفی برای کنترل این محدودیت پیشنهاد کردهاند. به عنوان مثال تغییر شکل در دمای بالا باعث نزدیک تر شدن تنش برشی بحرانی حرکت نابه جاییها در صفحات قاعدهای و غیر قاعدهای میشود. همچنین استفاده از عناصر آلیاژی که باعث تغییر نسبت ارتفاع به عرض شبکه در بلور هگزاگونال منیزیم میشوند نیز به عنوان راهی دیگر برای افزایش شکلپذیری آلیاژهای منیزیم مورد توسعه قرار گرفتهاست. در روش سوم برای افزایش شکلپذیری منیزیم با استفاده از تغییر شکلهای نامتقارن (مانند نورد نا متقارن ورق) از هم جهت شدن دانهها جلوگیری میشود. با وجود ارائه راهکارهای متفاوت عموماً این روشها هزینه تولید را به شدت بالا برده و توجیه اقتصادی برای تولید انبوه را برای کاربردهای معمول زیر سؤال میبرد. این محدودیت آلیاژهای منیزیم سبب شده بیش از ۹۰٪ قطعات صنعتی ساخته شده با این آلیاژها با روشهای ریختهگری تولید شود و عموماً از تغییر شکل این آلیاژها مگر در موارد خاص اجتناب شود.
۲_ برای افزایش خواص مکانیکی در کاربردهای صنعتی، منیزیم با عناصر دیگر مخلوط شده و آلیاژهای مختلف تولید میشود. در آلیاژهای متداول و پر کاربرد منیزیم، افزایش استحکام از طریق ایجاد رسوبات مختلف صورت میپذیرد. این مکانیزم افزایش استحکام برای کاربرد در دماهای پایین بسیار مؤثر است. اما با افزایش دما این رسوبات در فاز زمینه حل شده و این آلیاژها در دماهای بالا به شدت استحکام خود را از دست میدهند. از این رو استفاده از این آلیاژها در دماهای بالا و در شرایط تغییر شکل خزشی به چالشی برای دانشمندان تبدیل شدهاست. برای این محدودیت هم چارههای مختلفی اندیشیده شدهاست. از جمله این راهکارها میتوان به تولید آلیاژهای خاص با رسوبات مقاوم به حرارت و تولید کامپوزیتهای پایه منیزیم با ذرات تقویت شده سرامیکی اشاره کرد. در حال حاضر آلیاژهایی با مقاومت خزشی مناسب در دمای حداکثر ۴۰۰ درجه سانتی گراد ابداع شده و به صورت صنعتی مورد استفاده قرار گرفتهاست.
۳_ سومین محدودیت قابل ملاحظه منیزیم واکنشپذیری بالای این فلز است. منیزیم با الکترونگاتیویته۳۱/۱ تقریباً قابلیت الکترون دهندگی به همه فلزات را دارا است. از این رو در تماس با آنها پیل الکترو شیمیایی تشکیل شده، منیزیم خورده شده و فلز دیگر محافظت میشود. این خاصیت منیزیم برای تولید آندهای فدا شونده به نحو احسن استفاده میشود. اما در کاربردهای صنعتی، خوردگی بالا به عنوان محدودیت در کاربرد در نظر گرفته میشود. برای این محدودیت نیز راهکارهای متعددی بر پایه آلیاژسازی و اصلاح ریز ساختار پیشنهاد شدهاست. لازم است ذکر شود که خوردگی سریع منیزیم در برخی کاربردها به عنوان مزیت نیز شناخته میشود. برای مثال از برخی از آلیاژهای منیزیم برای تولید استنتهای زیست تخریب پذیر برای درمان رگهای گرفته شده قلب استفاده نمود. این نوع از استنتها نیازی به جراحی مجدد برای خارج کردن نداشته و در مدتی کنترل شده به تدریج در محیط بدن حل میشوند.
در دماهای بالا واکنشپذیری بالای منیزیم به صورت احتراق در دمای پایینتر از دمای ذوب خود را نشان میدهد. این مسئله نیز در کاربرد و تولید قطعات منیزیمی موانعی ایجاد کردهاست. به عنوان مثال تا سال ۲۰۱۵ استفاده از قطعات منیزیمی داخل کابین هواپیماهای مسافربری ممنوع بودهاست. با این وجود، با پیشرفت تکنولوژی و معرفی آلیاژهای جدید مقاوم به احتراق، این ممنوعیت مطلق برداشته شده و به جای آن لزوم رعایت استاندارد جدید و مقاومت در آزمایشهای سخت گیرانه جایگزین شدهاست. در فرایندهای تولیدی مانند ریختهگری که ایجاد مذاب منیزیم اجتناب ناپذیر است نیز روشهای متعددی برای کنترل احتراق مورد استفاده قرار میگیرد. از جمله این روشها میتوان به استفاده از فلاکسها (عموماً نمکهای کلریدی و فلوریدی) و گازهای محافظ اشاره کرد
تولید
تولید منیزیم از آب دریا
در روش تولید منیزیم از آب دریا، منیزیم به صورت هیدروکسید رسوب کرده و به وسیلهٔ واکنش با اسیدکلریدریک، به کلرید منیزیم تبدیل میشود. کلرید منیزیم به وسیلهٔ تبخیر محلول، بازیافت شده و فلز منیزیم به وسیلهٔ الکترولیز نمک مذاب بدست میآید.
فرایند الکترولیت
اولین مرحله از این فرایند فراهم کردن کلرید منیزیم-که بهطور جزئی دهیدراته شده- یا کارنالیت دهیدراته است. تغذیههای سلول صنعتی شامل مخلوطی از کلرید منیزیم دهیدراته، کلرید منیزیم جزئی دهیدراته شده یا کارنالیت دهیدراته است.
کلرید منیزیم دهیدراته شده به وسیلهٔ یکی از این دو روش فراهم میشود: کلرید کردن اکسید منیزیم یا دهیدراته کردن آب نمک کلرید منیزیم.
سلول الکترولیتی شامل مخزن آجر کاری شدهاست که به محفظههای کاتد و آند تقسیم میشود. آند گرافیتی هوا- خنک شونده یا آب- خنک شونده و کاتد فولادی در الکترولیت متشکل از کلریدهای قلیایی با افزودنی کلرید منیزیم، غوطه ور میشوند. دمای کاری بین ۷۵۰–۶۸۰ درجه سانتی گراد است. کلرید منیزیم در سلول الکترولیتی مطابق واکنش زیر تجزیه میشود:[۳]
MgCl_2→Mg+Cl_2
منیزیم فلزی در کاتد تشکیل شده (روشنتر از الکترولیت است) و شناور میشود تا در قسمت کاتد جمع شود. کلر که محصول فرعی این فرایند است در آند جمع میشود.
در کشورهایی که انرژی الکتریکی ارزان است و بازار مصرف پایداری نیز وجود دارد، تولید به روش الکترولیز به صرفه است. این مقرون به صرفه بودن زمانی بیشتر است که کلرید منیزیم مورد نیاز از منبعی مثل آب دریا تأمین شود.[۴]
فرایند احیای سیلیکوترمی
منیزیم طی فرایند سیلیکوترمی در دماهای بالا با فروسیلیسیم کاهش یافته و کریستالهای منیزیم تشکیل میشوند. این فرایند شامل احیای اکسید منیزیم مذاب به وسیلهٔ فروسیلیسیم تحت خلأ در دمای حدود ۱۴۰۰ درجه سانتی گراد است. منیزیم فلزی در این فرایند تشکیل شده، تبخیر میشود و سپس دور از منطقه گرم تقطیر میگردد. منیزیم تقطیر شده دارای خلوص ۹۹٫۸٪ است و سپس مجدداً ذوب و ریختهگری میشود.[۵][۶]
حال در انتهای این بخش به دلیل موضوعیت این فرایند در گزارش تهیه شده و استفاده از این روش به عنوان تنها روش تولید منیزیم در کشور، لازم دیده میشود که این فرایند را بهطور خلاصه شرح دهیم.
به صورت کلی این فرایند از ۴مرحله اصلی و چندین مرحله کنترلی تشکیل شدهاست که در ادامه به آنها پرداخته میشود.
واحد کلسیناسیون
در واحد کلسیناسیون ابتدا سنگهای دولومیت استخراج شده پس از دپوسازی به واحد کنترل منتقل شده و میزان خلوص منیزیم در آنها مورد بررسی قرار میگیرید، پس از تأیید شدن سنگهای استخراجی، این سنگها را غربال کرده و از لحاظ ابعادی بهینه میگردند. سپس به منظور افزایش خلوص منیزیم موجود در دولومیتهای استخراجی و آمادهسازی برای تحویل به بخش احیا، سنگها را وارد کورهٔ دوار میکنند، در این بخش سنگها موجود در دما ۱۲۰۰درجه سلسیوس قرار گرفته و گاز دیاکسید کربن خود را همانطور که در معادله زیر به آن اشاره شدهاست از دست میدهند.
(MgCO_3.CaCO_3 (solid)+Q→MgO.CaO(solid)+2CO_2+O_2(g
پس گذر سنگهای مورد نظر از این بخش، سنگهای خاکستری اولیه به رنگ سفید درآمده و به بخش بعدی منتقل میگردد. لازم است ذکر شود که گاز خروجی از این کوره حاوی مقادیر قابل توجهی از آب و دیاکسید کربن است که بررسی چگونگی استفاده از ضایعات تولیدی خود میتواند مفصلاً مورد بررسی قرار گیرد.
واحد آسیا و بریکتسازی
در این بخش دولومیتهای کلسینه شده به منظور آمادهسازی برای تحویل به بخش احیا به نسبتهای مشخصی با فروسیلیس(۷۵درصد کربن) و فلورین مخلوط میگردد، این مواد مخلوط شده سپس وارد آسیا گشته و در چندین مرحله پودر میشوند.
پس از مراحل فوق مواد آسیا شده به منظور بهینهسازی شکلی و ابعادی، به شکل بریک درآورده شده و در محفظههایی برای انتقال به مرحله بعد نگهداری میشوند.
واحد احیاء منیزیم
در این مرحله بریکتها را درون محفظهای استوانهای شکل که ریتورت نام دارد، شارژ میکنند. پس شارژ ریتورتها، داخل محفظه ریتورتها توسط دو پمپ خلأ در دو مرحله تخلیه میشود، اولین پمپ فشار داخل ریتورت را به فشاری در حدود ۱۱۰ پاسکال رسانده و دیگر این فشار را به حدود ۱۰الی ۵ پاسکال میرساند. ابن فرایند احیاء حدود ۱۰ ساعت به طول میانجامد که در طی آن منیزیم موجود در بریکتها توسط فروسیلیس احیاء شده و به سمت دیگر ریتورت که کندانسور تعبیه شده و فشار کمتری دارد منتقل میشود. سپس منیزیم در محفظهٔ ابتدایی ریتورت که محفظه چگالش نام دارد از گاز به جامد تبدیل میشود که به اصطلاح آن را کرون یا تاج منیزیم مینامند. بقیه مواد داخل ریتورت که بریکت سوخته نام دارند نیز از ریتورتها تخلیه و در به عنوان دور ریخت جمعآوری میشود. فرایند گفته شده در بالا در معادله زیر خلاصه میشود.

کرونهای تولید شده در واحد احیاء
(2MgO.CaO(s)+Si(Fe)(s) →2Mg(g) +CaO.SiO_2(s) +Fe(s
کرونهای تولید شده در مرحله قبل، به خلوص مورد نظر رسیدهاند ولی به دلیل اشکال و اندازه غیر استاندارد و بد کرونهای سرد شده نیاز است که این کرونها در کورههای دوباره ذوب شده و برای بستهبندی و فروش به شمش تبدیل شوند.[۷]
مشخصات شیمیایی
منیزیم در حالت پودری، گرم میشود و زمانی که در معرض هوا قرار میگیرد، آتش گرفته و با شعلهای به رنگ سفید میسوزد. این فلز قلیایی خاکی عمدتاً به عنوان یک عامل آلیاژ دهنده برای ساخت آلیاژهای آلومینیوم – منیزیم استفاده میشود. این عنصر به صورت سه ایزوتوپ یافت میشود: ۲۶Mg, ۲۵Mg, ۲۴Mg که همهٔ این ایزوتوپها به مقادیر زیاد یافت میشوند. حدود ۷۹٪ از منیزیم نوع ۲۴Mg است.
کانیها
اگر چه منیزیم در ۶۰ کانی یافت میشود اما این عنصر در ذخایر بزرگ منیزیت، دولومیت، بروسیت، کارنالیت، الیوین و سیلیکاتهای منیزیم پتانسیل اقتصادی دارند، یافت میشود.
کاربردهای عمده
کاربردهای منیزیم در صنایع مختلف به شرح زیر است:
- دیرگداز
- آلیاژ
- تولید فلز منیزیم
- داروسازی
- سولفور زدایی و نودولی شدن در صنعت آهن و فولاد
- کاربردهای شیمیایی
- اکسید منیزیم
- کربنات منیزیم
- بی سولفید منیزیم
- سولفات منیزیم * کلرید منیزیم
- هیدروکسید منیزیم
- منیزیای پختهشده
- مکمل غذای حیوانات
کاربرد آلیاژها
برای شکل دهی به روش کشش ورقهای منیزیم در دماهای پایین جهت تولید قطعات با عمق کشش کم، برای تولید قاب محصولات الکترونیکی ای مانند موبایل و کامپیوتر از طریق روش RUB امکانپذیر است، اما برای تولید محصولات ی با عمق کشش بالا و کشش عمیق باید از قالبهای گرم کار استفاده کرد و همچنین ایجاد گرادیان دمایی در سطح ورق جهت کششهای عمیقتر بسیار حایزاهمیت میباشد که با این کار باعث بالارفتن تنش تسلیم به صورت موضعی در نوک سمبه میشویم و باعث شکل دهیهای موفق تری میشود. در تست CCV متوجه شدیم که دمای بالا جهت شکل دهی منیزیم دارای یک حد نهایی میباشد و از یک دمایی بالاتر باعث پارگی در نوک سمبه میشود.
پیشنهادی که برای تحقیقات آینده ورقهای منیزمی میشود مطالعه و بررسی ورقهای دولایه منیزیم ای و تستهای کشش عمیق منیزیم دولایه و چند لایه و همچنین ارایه راهکار جهت کنترل دقیق تر گرادیان دمایی در قالب، نوک سمبه و ورق که در نهایت باعث بالارفتن سرعت در تولید قطعات میشود. بررسی قالبهای بزرگتر نظیر سقف اتومبیل و اجزا بدنه ان به روش گرم کار ورق منیزیم جهت تولید خودروهایی با وزن سبکتر.
آلیاژهای منیزیم به دلیل دارا بودن استحکام ویژه بالا جایگزین مناسبی برای فولاد و آلومینیوم برای استفاده در قطعات سبک در صنایع اتومبیل و الکترونیک هستند که این موضوع باعث افزایش تقاضای این آلیاژ شدهاست. البته ورقهای منیزیمی در دمای پایین تغییر شکل بسیار کمی دارند، که باعث محدودیت شدید کاربرد آنها شدهاست. این شکلپذیری کم ناشی از غالب بودن سیستم لغزش قاعدهای آن در تغییر شکل است که در قطعات کارشده این بافت قاعدهای بسیار شدید است. شکلپذیری ورقهای منیزیم بوسیلهٔ کاهش شدت بافت قاعدهای میتواند بهبود یابد[۸][۹][۱۰] از این رو تلاشهای زیادی برای کاهش این شدت به منظور بهبود شکلپذیری آن انجام شدهاست. ا فزودن عناصر آلیاژی مانند عناصر نادر خاکی و لیتیوم یک روش مؤثر برای تضعیف بافت قاعدهای است با این حال اضافه کردن این عناصر گرانقیمت، هزینهٔ تمام شده قطعه را افزایش میدهد؛ بنابراین نیاز به کنترل و کاهش بافت قاعدهای بوسیلهٔ به کاربردن تکنیکهای فرایندهای تولید است. در سالهای اخیر فرایندهایی مانند نورد نامتقارن،[۱۱] نورد متقاطع،[۱۲] خم کاری تکراری تک جهته،[۱۳] خم کاری تکراری، نورد کانال زاویهای با مقطع یکسان، شکلدهی غلطکی موجی، آنیل با دمای بالا قبل و بعد از نورد گرم، ترکیب نورد گرم و نورد دمای بالا[۱۴][۱۵] برای بهبود خواص ورقهای منیزیمی بکارگرفته شدهاست. در فرایند نورد به منظور جلوگیری از شکست و ایجاد ترک، پارامترهای فرایند برای آلیاژهای Mg باید به دقت کنترل شوند، دمای بالای نورد، نورد چند مرحلهای با کاهش ضخامت کم و آنیل کافی بین هریک از مراحل نورد در روش سنتی نورد به کار گرفته میشد.[۱۶] افزایش دمای فرایند برای شکلپذیری بهتر آلیاژ Mg به دو دلیل مفید است؛ اول این که سیستمهای لغزش غیر قاعدهای در دمای بالاتر فعال میشوند که این سیستمهای لغزش مستقل امکان شرکت در تغییر شکل را دارند[۱۷] و دلیل دوم تبلور مجدد دینامیکی است که با افزایش دما، افزایش مییابد و باعث کاهش سختی ماده حین تغییر شکل میشود.[۱۸]
پزشکی
منیزیم معدنی برای قلب، عضله و کلیه مهم و مفید است. این ماده قسمتی از دندان و استخوان شما را میسازد. مهمتر از همه، این ماده آنزیمها را فعال میکند، به شما انرژی میدهد و به کار کردن بهتر بدن کمک بسیاری میکند. این ماده همچنین استرس، افسردگی و بیخوابی را کاهش میدهد. ویتامین ب۶ به جذب منیزیوم مورد نیاز کمک میکند و با منیزیوم در بسیاری از کارها همکاری میکند. منیزیم در بسیاری از غذاها قابل دسترس است. اگرچه بسیاری از مردم در ایالات متحده منیزیم کافی از رژیم غذایی شان دریافت نمیکنند. قرصهای مغذی تنها میتواند به شما مقدار منیزیم دریافتی را نشان دهد. دانشمندان روشهای مختلفی برای مشخص کردن میزان منیزیم غذاهای متفاوت پیدا کردهاند. علاوه بر این بسیاری از غذاها بهطور کامل تجزیه نشدهاند.
بیماریهای طبی مشخصی تعادل منیزیم بدن را بهم میزند. برای مثال همراه با استفراغ یا اسهال میتواند منجر به کمبود منیزیم بهطور موقتی شود. بیماریهای معده و روده، دیابت. التهاب پانکراس، عملکرد بد کلیه و داروهای دیورتیک (ادرارآور) میتواند باعث کمبود طولانی مدت منیزیم شود. اگر مبتلا به یکی از بیماریهای ذکر شده هستید برای منیزیم مورد نیاز مصرفی تان، با پزشک مشورت کنید.
کاربردهای پزشکی
مصرف کافی منیزیم میتواند در موارد زیر کمک کند:
- جلوگیری از سخت رگی (تصلب شرایین)
- جلوگیری از حمله و سکته قلبی
- کاهش فشار خون
- کاهش چربی زرد (کلسترول) و تری گلیسیرین خون
- تصحیح بی نظمیهای ضربان قلب
- توقف حمله حاد آسم
- کاهش میزان نیاز به انسولین در صورت دیابتی بودن
- جلوگیری از تشکیل سنگ کلیه
- درمان بیماری کرون
- درمان سر و صدای ناشی از کاهش شنوایی
- بهبود بینایی در صورت داشتن آب سیاه
- کاهش گرفتگی ماهیچه، زود پریشی، خستگی، افسردگی و احتباس مایع مرتبط با قاعدگی
- جلوگیری از عوارض جدی آبستنی مانند پره اکلامپسی و اکلامپسی
- نگهداری و تجدید سطح انرژی طبیعی بدن
- بهبود چگونگی خواب
- کاهش دل نگرانی و افسردگی
- کاهش آزارها و آثارها استرس
منابع غذایی
غنیترین منبع منیزیم شامل (TOFU)، آجیل (بادام، پسته، گردوی سیاه) تخم کدو، تخمه آفتاب گردان، بادام زمینی، برگ سبز سبزیجات، غلات، گندم، آرد سویا، تخم کتان و ملاس.
منابع خوب دیگر برای منیزیم آرد گندم، آرد جو، چغندر سبز، اسفناج، خرده گندم، حبوبات، جودوسر، موز، سیب زمینی (با پوست)، پسته. همچنین میتوانید منیزیم را از بسیاری گیاهان گونههای علفها و جلبکها به دست آورید، برای مثال: جلبک آگار، گشنیز، شوید، دانه غلات، شاهپسند، خردل خشک، ریحان، پودر کاکائو، تخم رازیانه، مرزه، تخم زیره، تخم ترخون، تخم مرزنجوش و تخم خشخاش.
اشکال دیگر
منیزیم به اشکال مختلف در دسترس است. بهترین فرم آن به صورت «قابل حل» عرضه میشود، که بدن راحتتر منیزیم این ترکیب را جذب میکند. این ترکیبات قابل حل به صورت کپسول ژلاتینی است. مکملهای توصیه شده منیزیم شامل سیترات منیزیم، گلوکونات منیزیم و لاکتات منیزیم است.
دیگر منابع هم خانواده منیزیم شامل شیر منیزیم (هیدروکسید منیزیم) که اغلب به عنوان یک ملین یا آنتی اسید استفاده میشود، نمکهای «ایپوم» (سولفات منیزیم) که به عنوان یک ملین یا تقویتکننده استفاده میشود یا به وان حمام اضافه میشود. بعضی از اشکال منیزیم از طریق پوست قابل جذب است.
چگونگی مصرف
مقدار کمی از منیزیم را در روز با یک لیوان پر از آب (تا باعث اسهال نشود) مقادیر توصیه شده روزانه به شرح زیر است:
- مردان بزرگسال بین ۱۹ تا ۳۴ سالگی: ۴۰۰ میلیگرم بعد از ۳۰ سالگی: ۴۲۰ میلیگرم
- زنان بزرگسال بین ۱۹ تا ۳۴ سال: ۳۱۰ میلیگرم بالاتر از ۳۰ سال ۳۲۰ میلیگرم
- پسران در سن ۱۴ تا ۱۸ سال: ۴۱۰ میلیگرم
- دختران در سن ۱۴ تا ۱۸ سال: ۳۶۰ میلیگرم
- بچهها در سن ۹ تا ۱۳ سال: ۲۴۰ میل گرم، بچهها در سن ۴ تا ۸ سال ۱۳۰ میلیگرم و بچههای سن ۱ تا ۳ سال: ۸۰ میلیگرم.
موارد احتیاط
اگر بیماری شدید کلیوی یا قلبی دارید بدون مشورت پزشک از مکملهای منیزیم استفاده نکنید.
مصرف بیش از حد شیر منیزیم (به عنوان مسهل یا آنتی اسید) یا نمکهای ایپسوم (به عنوان مسهل یا تقویتکننده) باعث میشود که شما مقادیر زیادی منیزیم هضم کنید، به ویژه اگر مشکل کلیوی داشته باشید. مصرف زیاد منیزیم باعث ایجاد مشکلات جدی برای سلامتی و حتی مرگ میشود.
تداخلهای احتمالی
بعضی از غذاها، نوشیدنیها و داروها، باعث از دست دادن منیزیم بدن میشود.
سدیم (نمک)، کافئین، الکل، فیبر، ریبوفلاوین به میزان زیاد، انسولین دیورتیکها (ادرارآور) و دیجیتالها است.
بعضی از غذاها، نوشیدنیها و داروها، بدن را برای مصرف منیزیم مورد نیاز با مشکل و سختی روبرو میکند. اینها شامل کلسیم، آهن، منگنز، فسفر. روی و چربی است.
سوختن
در گذشته منیزیم به عنوان لامپ پرنور فلاش عکاسی استفاده میشد. فلز منیزیم به راحتی اکسید شده و هنگام سوختن نور قوی را ساطع میکند به همین دلیل نیز از این عنصر به صورت پودر شده و خالص در فلاشهای عکاسی استفاده میکردند.
منیزیم مادهای است که میتواند به عنوان گزینهای مناسب برای سوخت بشر قرار گیرد. همانطور که گفته شد گرما ایجاد شده از سوختن هر کیلو زغال سنگ برابر ۳۰ مگاژول بوده و گرمای تولید شده از سوختن هر کیلو منیزیم برابر ۲۵ مگاژول است که اندکی از زغال سنگ کمتر است.
نکته حائز اهمیت آنجاست که ذخیره و انتقال منیزیم بر خلاف هیدروژن بسیار آسان است.[۱۹]
منیزیم سوختی برای نیروگاههای حرارتی
سوختهای فسیلی اصلیترین منبع تأمین انرژی نیروگاههای حرارتی هستند و از طرف دیگر این نیروگاهها بزرگترین تولید کنند کربن دیاکسید در جهان نیز هستند؛ حال اگر روزی بتوانیم منیزیم را به صورت فراوان تولید کنیم آنگاه میشود بروی این عنصر به عنوان منبعی جایگزین برای سوختهای فسیلی در این نیروگاهها حساب باز کرد که این کار میتواند به مؤثرترین روش برای کاهش دیاکسید کربن تبدیل گردد.
همانطور که میدانید از واکنش شیمیایی پودر منزیم و آب، هیدروژن تولید میشود که افزایش سرعت این واکنش رابطه مستقیمی با میزان کوچکی دانههای پودر منیزیم خواهد داشت. با سرعت گرفتن واکنش ذیل هیدروژن شروع به سوختن کرده به این صورت که هیدروژن خروجی با اکسیژن واکنش داده و از واکنش آنها بخار آبی حاصل میشود که به دلیل فشار و دمای بالایش قادر به چرخاندن توربین برای تولید الکتریسیته خواهد بود.

نمونه اولیه از یک نیروگاه حرارتی در مقیاس آزمایشگاهی
Mg + H2O → MgO + H2
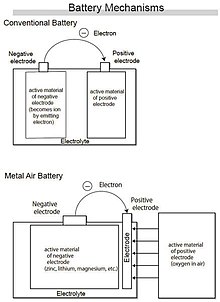
طرحی شماتیکی از باتری منیزیم هوا
محصول نهایی این واکنش منیزیم اکسید جامد و بخار آب است که هیچکدام تخریب زیستمحیطی نخواهد داشت و منیزیم اکسید تولیدی را نیز میتوان به وسیله چرخهٔ بازیافت منزیم توسط لیزر خورشیدی دوباره به منیزیم خالص که به عنوان سوخت رآکتور است تبدیل کرد.[۲۰]
باتریهای منیزیم-هوا
در باتریهای معمولی در الکترود منفی از مواد فعال الکترونده (این مواد عامل تولید الکتریسیته هستند) و در الکترود مثبت از مواد فعال الکترون گیرنده استفاده میشود. در Air Batteryها اکسیژن موجود در هوا به عنوان ماده الکترون گیرنده در الکترود مثبت قرار میگیرد و در الکترود منفی نیز مواد فعال الکترون دهنده قرار میگیرد.[۲۱] واضح است که به دلیل این که ماده خاصی در الکترود مثبت قرار نمیگیرد، چگالی انرژی در این باتریها نسبت به باتریهای متعارف دیگر به مراتب بالاتر است.
در باتری منیریم- هوا، منیزیم به عنوان مادهٔ فعال در الکترود منفی قرار میگیرد وقتی که منیزیم در الکترود منفی با اکسیژن در الکترود مثبت واکنش میدهد فرایند اکسید شدن رخ میدهد و انرژی الکتریکی تولید میشود و چیزی که باقی ماند اکسید منیزیم خواهد بود.
ما در اینجا به بررسی تفاوتهای بین موتور الکتریکی و اتومبیل با باتری منیزیم-هوا میپردازیم و هر دو طبقهبندی را با فرض آنکه قیمت منیزیم به حدی پایین بیاید که از آن بتوان به عنوان سوختی با صرفهٔ اقتصادی یاد کرد پیش میبریم.
بر اساس گزارش سازمان NEDO تا سال ۲۰۲۰ میلادی میزان مسافت طی شده توسط باتریهای یونی لیتیمی در یک دور شارژ کامل با وزنی حدود ۸۰ کیلوگرم به حدود ۲۰۰ کیلومتر خواهد رسید. حال با وزن ثابت میزان مسافت طی شده توسط باتری منیزیم- هوا، ۷ برابر خواهد شد و بهطور معکوس با میزان مسافت طی شده برابر، وزن این باتری در مقایسه باتریهای یونی لیتیمی به یک هفدهم تقلیل مییابد؛ و این حقیقتی است که در آینده باعث افزایش استفاده از این باتریها خواهد شد. قضاوت در مورد فضای اشغال شده توسط باتریهای یونی لیتیمی بر اساس وزن این باتری تصویر روشنی را به ما نمیدهند و این به معنی است که فضای اشغال شده توسط این باتری خارج از دسترس نخواهد بود ولی بدیهی است که باتریهای منیزیم هوا از لحاظ سایز نیز به مراتب استاندارد تر خواهد بود.
از منظری دیگر اکثر خودروها هنگام احتراق و تولید توان گاز دیاکسید کربن و دیگر گازهای مضر را تولید میکنند ولی باتریهای منیزیم-هوا از این نظر نیز سرآمد هستند ولی یکی از مشکلات اساسی این ماشینها سوختگیری و شارژر طاقت فرسا این باتریها است. به یاد دارید که یکی از مشکل اساسی خودروهای الکتریکی، زیر ساختهای ایستگاه سوختگیری و شارژ این خودروها بود بهطوریکه نیاز بود تا این ایستگاهها در فواصل کمی نسبت به هم قرار گیرند تا بتوانند شرایط پیمودن مسیرها طولانی را فراهم سازند؛ ولی باتریها منیزیم-هوا همانند خودروهای الکتریکی نیازمند زیرساختهای وسیعی نمیباشند و منیزیم را میتوان به راحتی در فروشگاههای مختلف جایگزین منیزیم اکسید موجود در باتری نمود.
همانطور که میدانید از فعالیت باتری منیزیم-هوا، اکسید منیزیم تولید میشود و ایده بسیار کارامدی خواهد بود اگر فرایندی را تبعیت کرد که در آن بتوان منیزیم اکسید موجود در باتری را پس از جایگزین نمودن با پک منیزیمی جدید، در چرخه بازیافت توسط لیزر-پمپ شده- خورشیدی قرار داد.[۲۲]
از این گذشته باتریهای یونی لیتیمی، در زمینه تأمین مواد خام اولیه نیز با مشکلاتی رو به رو هستند. بهطور معمول خودروها برای پیمودن مسافت ۵۰۰کیلومتری نیازمند توانی حدود ۱۰۰کیلووات ساعت هستند. حال به دلیل آنکه ظرفیت ویژه این عنصر برابر 3.83A.h/g بوده و لتاژ خروجی این باتریها برابر ۳ ولت است در نتیجه توانی برابر ۱۱٫۵ وات ساعت را به ازای هر گرم لیتیم تولید میشود که برای تأمین انرژی فوق، ۸٫۷کیلوگرم لیتیم نیاز خواهد بود (البته با فرض این که ۱۰۰٪ توان تولید توسط لیتیم قابل استفاده قرارگیرد). در حال حاضر ۹۰۰ میلیون خودرو در جهان در حال استفاده است که میزان لیتیم مورد نیاز برای تجهیز این تعداد خودرو برابر ۷٫۸۰۰٫۰۰۰ خواهد بود و با توجه به این که میزان ذخایر در حال دسترس فعلی لیتیم برابر ۴میلیون تن است در نتیجه حتی اگر کل این مقدار در زمینه تولید خودرو مصرف شود با این حال این میزان از منابع کفاف تأمین این تعداد خودرو را نخواهد داشت. در حال حاضر سرانه تولید منابع لیتیم در جهان برابر ۲۵٫۰۰۰تن است ولی انتظار میرود که با افزایش میزان تقاضا این مقدار در آینده به سرعت رشد کند و در حال حاضر نیز رقابتی در این زمینه در جهان الخصوص بین آمریکا جنوبی و کشور چین شروع شدهاست؛ ولی گفت این نکته لازم است که اگر باتریهای یونی لیتیمی فراگیر شوند در این صورت محدودیت ذخایری عنصر لیتیم نسبت به نفت خام بیشتر خواهد شد. همچنین گفته میشود که برای بازیافت لیتیم از باتریهای یونی لیتیمی مصرف شده بیشتر از هزینه تولید آنها به صورت معمول خواهد بود. آب دریا حاوی لیتیم است و تحقیقاتی در زمینه استخراج لیتیم از آب دریا در دست انجام است ولی در واقع میزان لیتیم موجود در آب دریا نسبت به میزان منیزیم بسیار ناچیز است به صورتی که در هر کیلوگرم آب دریا 1.29g منیزیم یافت میشود که این میزان برای لیتیم به 0.00001gدر هر کیلوگرم آب دریا تقلیل مییابد از طرفی در حال حاضر هزینه استخراج لیتیم از آب دریا حدود ۱۰۰ الی ۲۰۰ دلار خواهد شد و نیاز است که این هزینه برای کارآمد شدن و مطرح شدن لیتیم به عنوان سوخت کاهش یابد.
تحقیقات در مورد باتریهای فلز-هوا در منحصر به باتریهای منیزیم-هوا نمیشود بلکه از فلزاتی همچون آلومینیم، لیتیم و سرب نیز در این باتریها استفاده میشود اگر چه که از امر این تحقیقات زمان زیاد نمیگذرد. لازم است ذکر شود که میزان چگالی انرژی باتریهای لیتیم-هوا از نوع منیزیمی این باتریها بیشتر است و در صورت استفاده از این لیتیم خروجی بیشتری نسبت به منیزیم خواهیم داشت؛ ولی همانطور که در مورد باتریهای یونی لیتیمی گفته شد مشکل کمبود منابع در مورد این باتریها نیز صادق است به صورتی که برای ساخت و تجهیز وسایل الکتریکی زیادی نیاز به لیتیم و ترکیبات مختلف آن خواهیم داشت؛ ولی میدانیم که سوخت باتری منیزیم-هوا رامی توان با هزینه کمی بازیافت کرد و از طرفی دیگر میزان ذخایر منیزیم نسبت به لیتیم به مراتب بیشتر است. به همین دلیل است که میتوان منیزیم را به عنوان سوختی مطمئن تر نسبت به لیتیم یاد کرد.
بشر در آینده به سمت سوختی باید برود که از لحاظ، در دسترس بودن و فروانی منابع غنی بوده و بتواند توان کارآمدی را با چگالی انرژی بالا و با صرفه اقتصادی تولید نماید و از طرفی دیگر بتواند نیاز آلودگیهای محیط زیستی بشر که ناشی از سوختن منابع انرژی است را رفع کند. حال من حیث مجموع چرخه انرژی پاک جدید منیزیم و لیزر-پمپ شده- خورشیدی راه حلی است که میتواند کلیدی برای حل این مشکل باشد زیرا همانطور که در بخشهای گذشته به آن اشاره گردید این منبع ناتمام انرژی، با توجه به فراوانی و دانسیته انرژی بالا و پاک بودن چرخه تولید و استفاده میتواند به عنوان یکی از بهترین کاندیدها برای جایگزینی سوختهای فسیلی قرار گیرد.[۲۳]
کاربرد منیزیم در کشاورزی
منیزم یک از عنصر غذایی ماکرو که در رشد و سلامت گیاهان ضروری است.[۲۴]
مقدار منیزیم در گیاه
مقدار منیزیم بافتهای گیاهی حدود ۰۱/۵ تا ۱ در صد وزن خشک برگها هستند. مقدار منیزیم در برگها با افزایش سن گیاه افزایش یافته بطوریکه بیشترین غلظت آن در برگهای پیر دیده میشود. مقدار منیزیم قابل استفاده در خاک (محلول و قابل تبادل) با روش استات آمونیوم یک نرمال۵۰۰ میلیگرم در کیلوگرم پیشنهاد میشود.[۲۵]
نقش منیزیم در گیاه
کوفاکتور بسیاری از واکنشهای آنزیمی و دریافت کنندهٔ، پروتئین بوده و در تنظیم کانالهای غشاء (بارکر و پیلبام، ۲۰۰۷) حفظ ساختار ریبوزوم، تنفس و تشکیل قندها نقش دارد (فاگریا، ۲۰۰۹). منیریم در سنتز پروتئین، فعال سازی آنزیمها، جذب و انتقال فسفات، توزیع هیدروکربنها، ساخت کلروفیل و فتوسنتز، مصرف کودهای منیزیمی نیز در بهبود کمی و کیفی گلهای زینتی ضروری است.[۲۶]
با عنایت به نقش منیزیم در سنتز پروتئین، فعالسازی آنزیمها، جذب و انتقال فسفات، توزیع هیدروکربنها، ساخت کلروفیل و فتوسنتز، مصرف کودهای منیزمی نیز در بهبود کمی و کیفی گلهای زینتی ضروری است. مقدار منیزیم قابل استفاده در خاک (محلول و قابل تبادل) با روش استات آمونیوم یک نرمال ۵۰۰ میلیگرم در کیلوگرم پیشنهاد میشود.[توسط چه کسی؟] منیزیم در جذب کلسیم و پتاسیم در گیاه، نقش دارد (قاسمی چپی و همکاران، 1388). کاربرد مقادیر زیاد کودهای پتاسیمی یا بالا بودن میزان پتاسیم و کلسیم در خاک میتواند منجر به کاهش میزان منیزیم گیاه شود؛ تا جایی که در بسیاری از خاکها جذب منیزیم بیشتر تابع حلالیت پتاسیم است تا مقدار منیزیم خاک. برخی از محققین بر این باورند[الفاظ طفرهآمیز] که منیزیم ممکن است در مکانهای دور از دسترس در میان لایههای رسهای ۲:۱ حبس شود. نسبتهای پتاسیم به منیزیم برای رشد مناسب گیاهان متغیر است. این مقدار را برای گیاهان زراعی در خاک، پنج، برای سبزیجات و چغندر، سه، و برای درختان میوه و گیاهان گلخانهای دو پیشنهاد کردهاند.[توسط چه کسی؟] افزایش کودهای آمونیومی بهویژه هنگامی که نیتریفیکاسیون انجام نشده و نیتروژن به شکل آمونیوم جذب گیاه میشود، منجر به کاهش جذب منیزیم شده، بهطوری که مصرف کودهای محتوی منیزیم از جمله سولفات مضاعف پتاسیم، منیزیم و سولفات منیزیم برای افزایش عملکرد و بهبود کیفیت گلها پیشنهاد میشود.[۲۷]

زمانی که منیزیم به مقدار کافی وجود داشته باشد جذب CO2 را 140 ٪ افزایش می دهد، که منجر به افزایش زیست توده به میزان 61 ٪ در مقایسه با گیاهان دارای کمبود منیزیم میشود. همچنین نسبت بخش هوایی به ریشه نه تنها به تغذیه منیزیم حساس است ، بلکه بسیار تحت تأثیر روش کشت تجربی گیاه است.اگر گیاهان در مراحل رشد اولیه و قبل از قرارگیری در معرض کمبود منیزیم ، تحت مقدار کافی منیزیم رشد کنند، نسبت اندام هوایی به ریشه تحت تأثیر قرار نمیگیرد. در غیر این صورت ، نسبت بخش هوایی به ریشه به طور قابل توجهی کاهش میابد(Melanie Hauer-Jákli and Merle Tränkner, 2019). منیزیم به عنوان تنها عنصر فلزی موجود در کلروفیل است که در مرکز آن قرار گرفته، کمبود این عنصر سبب کاهش در میزان کلروفیل می شود و متوجه شده اند که بدون وجود این ترکیب، زندگی گیاه مختل می شود. منیزیم در متابولیسم مواد هیدروکربنه مخصوصا در چرخه اسید سیتریک که در تنفس گیاه موثر است، نقش دارد و همچنین موجب انتقال فسفر به دانه در گیاهان میشود و همچنین فعال کننده تعداد زیادی از آنزیم ها مانند، دی هیدروژناز و دی کربوکسیلاز است. وجوداین عنصر برای متابولیسم پتاسیم کلسیم، ویتامین C، فسفر الزامی است. منیزیم برای تبدیل قند خون به انرژی بسیار مهم می باشد و به عنوان ماده ضد استرس درنظر گرفته میشود. با مصرف مناسب کودهای منیزیم دار برای گیاهان علوفه ای و سایر محصولات که دچار کمبود این عنصر هستند، می توان میزان محصول را افزایش داد همچنین تغذیه کافی با این عنصر میتواند بر سلامتی انسان و دام نیز تاثیرگذار باشد(یعقوبی خانقاهی و همکاران، 1389).
کود منیزیم
به کار بردن مقداری زیاد از کودهای پتاسیمی یا بالا بودن میزان پتاسیم و کلسیم در خاک میتواند منجر به کاهش میزان منیزیم گیاه شود تا جایی که در بسیاری از خاکها جذب منیزیم بیشتر تابع حلالیت پتاسیم است تا مقدار منیزیم خاک. برخی از محققین بر این باورند که منیزیم ممکن است در مکانهای غیرقابل دسترس در میان لایههای رسهای ۲:۱ حبس شود. نسبتهای پتاسیم به منیزیم برای رشد مناسب گیاهان متغیر است. این مقدار را برای گیاهان زراعی در خاک، پنج، برای سبزیجات و چغندر، سه، برای درختان میوه و گیاهان گلخانه ای دو پیشنهاد کردهاند. افزایش کودهای آمونیومی به ویژه هنگامی که نیتریفیکاسیون انجام نشده و نیتروژن به شکل آمونیوم جذب گیاه میشود، منجر به کاهش جذب منیزیم شده، به طوری که مصرف کودهای محتوی منیزیم از جمله سولفات مضاعف پتاسیم، منیزیم و سولفات منیزیم برای افزایش عملکرد و بهبود کیفیت گلها پیشنهاد میشود.[۲۸]
علائم کمبود منیزیم
از نشانههای کمبود منیزیم در گیاه، زردی بین رگبرگ هاست. ابن کمبود ابتدا در برگهای پیر مشاهده میشود و در صورت کمبود شدید، برگها شروع به ریزیش میکنند. در خاک منیزیم به نسبت سریع شسته شده و از دسترس گیاه خارج میگردد. برای رفع کمبود منیزیم از کربنات و سولفات منیزیم استفاده شود.[۲۹]در صورت کمبود شدید، کل برگ زرد کم رنگ شده و در نهایت قهوه ایی و از بین میرود (حسندخت، 1386)[۳۰]همچنین رشد ریشهها کاهش یافته و قرمز تیره میشوند (فاگریا، ۲۰۰۹). به صورت یون Mg2+ جذب شده و نسبت به کلسیم تحرک بیشتری در گیاه دارد. کمبود منیزیم بهطور فراوانی در خاکهای ماسه ای با PH پایین یا مقادی بالای کلسیم و پتاسیم رخ میدهد (مرکریو، 2007).[۳۱] منیزیم، به عنوان یک عنصر معدنی ضروری برای گیاهان و میکروب ها، می تواند تأثیرات غیر مستقیم و مستقیم بر بیماری داشته باشد. تغذیه متعادل برای بیان مقاومت در برابر بیماری بسیار مهم است زیرا تغذیه بخشی از یک غذای کاملا متعادل است. کمبود یا بیش از حد بودن منیزیم می تواند طیف وسیعی از عملکردهای فیزیولوژیکی را تحت تأثیر این فرآیندهای مرتبط قرار دهد. توانایی منیزیم در تعامل و یا عدم تعامل با سایر مواد معدنی می تواند منجر به پاسخ های مختلف بیماری به منیزیم تحت شرایط مختلف محیطی شود برای مثال، پاتوژن های پژمردگی فوزاریوم در صورت وجود مقدار کافی منیزیم، شدت کمتری دارند.در مقابل، میزان بالای منیزیم که با جذب کلسیم تداخل می کند ممکن است بروز بیماری هایی مانند لکه های باکتریایی در گوجه فرنگی و فلفل یا پوسیدگی غلاف بادام زمینی را افزایش دهد(Don M. Huber and Jeff B. Jones, 2013).
نورد منیزیم
آلیاژهای منیزیم به دلیل سبک بودن هر روز با استقبال بیشتری مواجه میشوند اما با این وجود فرایندهای تولید آنها به دلیل خصوصیات منیزیم محدود است. فلزات به صورت ورق یکی از اشکال اساسی مورد استفاده در کاربردهای صنعتی هستند. تقریباً همه فلزاتی که برای کاربردهای سازه ای مورد استفاده قرار میگیرند به شکل ورق نیز موجود است اما منیزیم به دلیل دارا بودن ساختار هگزاگونال این امر مشکل میسازد. ساختار منیزیم مکانیزمهای فعال تغییر شکل این فلز را حداقل در مقایسه با فلزات با ساختار مکعبی محدود میسازد؛ بنابراین قابلیت شکلگیری و چقرمگی که از الزامات اولیه در فرایندهای شکلدهی هستند نیز محدود هستند. امکان تولید ورقهای منیزیم در دهههای قبل نشان داده شدهاست اما در حال حاضر کاربرد خاصی ندارد مطالعات جدید بر تأثیر پارامترهای فرایندی به خصوص دما بر ممکن بودن فرایندهای سنتی شکلدهی تأکید دارد علاوه بر آن به تازگی کشف شده که آلیاژهای حاوی عناصر آلیاژی به خصوص عناصر کمیاب خاکی در هنگام نورد تمایل به نشان دادن خواص ریزساختاری و به خصوص بافتی مختلفی دارند که تأثیر قابل توجهی در خواص ورق تولیدی دارد.
یکی از موانع اصلی پیش روی استفاده گسترده از ورقهای منیزیم اقتصادی نبودن فرایند تولید آن در مقایسه با روشهای دیگر ساخت از جمله ریختهگری دو غلطکه (twin-roll casting) است.
یکی از دلایلی که از ریختهگری پیوسته (Direct chill casting) برای تولید ورقهای آلیاژی منیزیم استفاده نمیشود این است که در این روش عناصر آلیاژی به مرکز ضخامت ورق پس زده میشوند و به همین دلیل خواص ورق را غیریکنواخت کرده و این فرایند برای تولید ورقهای آلیاژی مناسب نیست. فرایند تولید ورقهای منیزیم با ماده اولیه که برای نورد استفاده میشود آغاز میشود. ماده اولیه نبرد معمولاً اسلبها هستند که با فرایند دیسی کستینگ تولید میشوند. پیوسته بودن این فرایند به ما این اطمینان را میدهد که در طول ریختهگری دارای ساختار یکنواختی هستیم. همچنین برای استفادههای با تعداد کمتر همانند مقیاسهای آزمایشگاهی از ریختهگری با کمک جاذبه (gravity casting) استفاده میشود.

نمایی از ریختهگری پیوسته (غیر منیزیم)
قطعات تحت فرایند همگن سازی قرار میگیرند و سپس در صورت نیاز با ماشین کاری به اندازههای مورد نیاز در میآیند. آنیل کردن اگر در دمای مناسب آلیاژ مورد نظر انجام شود تأثیر چندانی در اندازه دانه ندارد و بیشتر به عنوان همگن سازی توزیع عناصر و حل کردن رسوبات فاز ثانویه که ناشی از فرایند ریختهگری اولیه برای تولید اسلبها هستند مورد استفاده قرار میگیرد. مسئله اصلی در اینجا همگن بودن ریزساختار در اسلب است. دماهایی که اسلبها در آن مورد عملیات آنیلینگ قرار میگیرند در جدول منبع[۳۲] که توسط چبی و لهنرت[۳۳] ارائه شده آورده شدهاست که دمای آنیلینگ با دمای فاز جامد آلیاژ مورد نظر مرتبط است. اسلب فلز سپس از میان دو غلتک که فاصله میان آنها از ضخامت ورق اولیه کمتر است رانده شده و بنابراین تغییر شکل پلاستیک در ماده رخ میدهد جدول منبع همچنین شامل تعدادی از دماهای متوسط اعمالی در حین عملیات نورد است که توسط بک[۳۴] در سال ۱۹۳۹ ارائه شدهاست. برای منیزیم و فلزات دیگر دو نوع فرایند نورد وجود دارد که شامل نورد گرم و نورد سرد است. بدین صورت که اگر دمای فرایند بالاتر از دمای تبلور مجدد آلیاژ مورد نظر باشد به فرایند نورد گرم و اگر دمای فرایند پایینتر از دمای تبلور مجدد باشد به آن نورد سرد گفته میشود.
رابطه میان پارامترهای فرایندی و خواص ورق
خواص ورق برای مثال خواص مکانیکی آن میتواند مرتبط با برنامه نورد اعمالی باشد. دیگر جنبههای مهم کیفیت ورق به خصوصیات دیگر ماشین مورد استفاده برای این فرایند بستگی دارد. همگن بودن گیج نهایی و شکل ورق تولیدی مستقیماً با غلتکهای مورد استفاده مرتبط است. همچنین کیفیت سطحی به نوع روانکار مورد استفاده و نحوه روانکاری در طول فرایند نورد بستگی دارد. فرایند گرم در طول نورد ورقهای آلیاژهای منیزیم مستقیماً با تبلور مجدد دینامیک همراه است جایی که خواص ریز ساختاری مرتبط با شکل دهیهای پیشین به راحتی از دست میرود. در نتیجه بهطور معمول مشاهده میشود که طیف ریزساختار قابل دستیابی بعد از این فرایند باریک است. برای مثال اندازه دانه و شدت بافت بهطور مشخص تغییری نمیکند. این مسئله باعث شده که فعالیتهای پژوهشی محدودی در زمینه تأثیر پارامترهای نورد برخی خواص محصولات مسطح منیزیوم در مقایسه با قطعات مکعبی مانند فولاد و ورقهای آلومینیوم صورت گیرد. کنترل بافت کریستالوگرافی به عنوان کلیدی در تعیین شکلپذیری بهبود یافته ورق که برای توسعه تعداد کاربردهای صنعتی بسیار ضروری است معرفی شدهاست بنابراین مطالعات اخیر در زمینه درک بهتر رابطه میان ریز ساختار اولیه قبل از شروع نورد، دمای نورد، کاهش ضخامت در هر پاس، کاهش کلی ضخامت نبرد و بافت نهایی متمرکز شدهاست. دمایی که فرایند نورد در آن انجام میشود پارامتر تعیینکننده است به دلیل اینکه مکانیزمهای مشخص شکل دهی در آلیاژهای منیزیم همانند لغزش نابجایی غیر بیسال درست مانند اتفاق افتادن تبلور مجدد دینامیک با افزایش دما فعال میشود و تغییر شکل مورد نظر میتواند بدون شکست یا پارگی در ورق انجام شود. در نتیجه تعدادی دیگر از پارامترهای فرایند رامی توان برای تأثیر گذاری در خواص ورق نهایی مسئول دانست. میزان کاهش ضخامت در هر پاس از نورد از آنجایی که نرخ کرنش را همانند مقدار تغییر شکل قبل از بازیابی و تبلور مجدد قطعه تغییر شکل یافته در طول آنیل کردن متوسط تعیین میکند بر ریز ساختار و بافت نهایی تأثیر میگذارد. افزایش سرعت نبرد منجر به کاهش اندازه دانه متوسط ورقهای منیزیم میشود همانطور که به وسیلهٔ اسادیقی و همکاران[۳۵]برای آلیاژ AZ31 نشان داده شدهاست. علاوه بر پارامترهای فرایند دیگر جنبهها نیز برای دستیابی به خواص مطلوب ورق مهم هستند. از این عوامل میتوان به روش نورد برای مثال نورد یک جهته یا برعکس کردن جهت ورق بعد از هر پاس نورد یا نورد ضربدری اشاره کرد. بهطور کلی برای دستیابی به قطعات مورد نظر از جنس منیزیم به دلیل ریز ساختار این فلز تا حد امکان سعی میشود از روشهای دیگری غیر از نورد استفاده شود مگر آن که از تولید قطعه به این روش توجیه اقتصادی یا کاربردی داشته باشد.[۳۲]
ریختهگری منیزیم
ریختهگری منیزیم (به انگلیسی: Magnesium Casting) روش ریختهگری متداولترین روش تولید قطعات منیزیمی میباشد به طوریکه تقریباً ۹۸ درصد از قطعات تولید شده با منیزیم، ریختهگری شدهاند. منیزیم را میتوان با روشهای مختلف ریختهگری کرد، که متداولترین آنها روش ریختهگری با فشار بالا (HPDC) میباشد. پس از خالص سازی دانههای منیزیم برای ایجاد هندسههای مختلف منیزیم از فرایند ریختهگری استفاده میکنیم. در این فرایند ابتدا دانههای منیزیم که به شکلهای متفاوت هستند را داخل یک کوره مخصوص تا دمای ۶۶۰ درجه سانتیگراد گرم میکنیم تا منیزیم به حالت مذاب در بیاید. برای ذوب منیزیم میتوان از بوتههای آهنی استفاده نمود و این موضوع یک مزیت بسیار بزرگ منیزیم نسبت به آلومینیوم است، زیرا آلومینیوم به شدت با آهن واکنش پذیر است و این امکان برای فلز آلومینیوم فراهم نمیباشد. بعد از ۵ دقیقه انتظار، با استفاده از یک پروانه از جنس فولاد ضدزنگ با پوشش نیترید بور شش تیغه که در مدت زمان ۳۰ دقیقه با دور ۱۵۰ دور در دقیقه میچرخد، برای هم زدن مذاب استفاده میشود. (البته این فرایند بیشتر زمانی مورد استفاده قرار میگیرد که مذاب حاصل از یک آلیاژ باشد یا اینکه مذاب یک دست نباشد) به منظور کاهش اکسیداسیون و سوختن مذاب در این مرحله و مراحلی که مذاب در تماس با هوای آزاد است، یک شار ثابت از مخلوط گازهای آرگون و هگزا فلورید گوگرد (Ar-SF6) (به نسبت ۱:۵) را در کوره تزریق میکنیم.
MgF2 تمایل دارد تا منافذ موجود در فیلم منیزیم اکسید (MgO) را پر کند و آن را مستحکم تر سازد. فرایند بدون شار با استفاده از گاز غیر سمی SF6 به عنوان جو محافظ (protective atmosphere) به سرعت توسط هر دو صنعت تولیدکنندگان شمش منیزیم و بخشهای ریختهگری صنعت ریختهگری منیزیم پذیرفته و عملیاتی شد، این امر به خاطر بهبود کیفیت عملیات ذوب و حذف مواد اضافی از مذاب صورت گرفت. با این حال، SF6 دارای پتانسیل گرمایش زمین به مقدار ۲۴۰۰۰ برابر گاز CO2 است، علاوه بر این به مدت بسیار طولانی (۳۲۰۰ سال) در جو زمین ماندگار خواهد بود. در سالهای اخیر گازهای محافظ جایگزین مانند HFC134a , HFE7100 و NovacTM612 گسترش یافته و مورد استفاده قرار میگیرند، در حالیکه گازهای HFC134a و HFE7100 هنوز بهطور قابل توجهی پتانسیل گرمایش جهانی (GWP) دارند، هر دو آنها بهطور قابل توجهی GWP کمتری نسبت به گاز SF6 دارند و با جایگزینی سریع این گازها، میتوان تا ۹۸ درصد اثرات گازهای گلخانه ای را کاهش داد. البته امیدوار کنندهترین حالت استفاده از گاز جایگزین NovacTM612 میباشد که GWP معادل گاز CO2 دارد، اما در حال حاضر توسعه و بهبود بیشتری برای استفاده از این گاز در صنعت ریختهگری منیزیم نیاز است.[۳۶] پس از هم زدن مذاب، اکسیدهای احتمالی باقی مانده در سطح فوقانی مذاب توسط یک کارگر یا ربات با استفاده از یک بیلچه از جنس فولاد ضدزنگ با پوشش نیترید بور جمعآوری میشوند و داخل حوضچه بازیافت ریخته میشوند. منیزیم را میتوان به روشهای متفاوت ریختهگری نمود که بستگی به استفاده و کاربرد آن خواهد داشت. در ذیل به توضیح این روشها میپردازیم:[۳۷]
ریختهگری منیزیم به روش شمشریزی
یکی از روشهای متداول و محبوب ریختهگری منیزیم روش شمش ریزی است، زیرا این روش جزو روشهای ریختهگری پیوسته یا نیمه پیوسته محسوب میشود و سرعت آن بسیار بالاتر از بقیه روشها است. البته میبایست به این نکته نیز توجه کرد که قطعات تولیدی در این روش قطعه نهایی نیستند بلکه مواد اولیه برای کارگاهها و صنایع دیگر هستند.
ریختهگری منیزیم به روش تحت فشار
ریختهگری با فشار بالا (HPDC) یا دایکست (Die Cast)
این روش انعطافپذیری بالایی در طراحی و ساخت قطعات سبک دارد. ویژگیهای مناسب و منحصر به فرد فیزیکی منیزیم باعث میشود که دیوارههای نازک با هندسه پیچیده را با این روش بتوان تولید کرد. دستگاههای مختص به روش ریختهگری با فشار بالا دو دسته هستند که در ذیل تشریح شدهاند:
ریختهگری با فشار بالا با استفاده از محفظه داغ

ریختهگری با فشار بالا با استفاده از محفظه داغ
در این روش منیزیم مذاب، در یک محفظه فولادی با دمای بالا و اتمسفر کنترل شده (با گازها مخصوص که بالاتر ذکر شد) در داخل دستگاه دایکست نگه داری میشود. مذاب منیزیم با استفاده از یک پیستون و یک لوله گردن غازی به داخل راهگاه و قالب هدایت میشود.
ریختهگری با فشار بالا با استفاده از محفظه سرد

ریختهگری با فشار بالا با استفاده از محفظه سرد
در این روش منیزیم مذاب در محفظه ای خاص خارج از دستگاه دایکست نگه داری میشود و توسط یک کارگر یا یک بازوی رباتیک، منیزم از داخل محفظه به داخل دستگاه و سیستم راهگاهی تزریق میشود. بسته به نوع قطعه و کاربرد آن میتوان از هر دو این دستگاهها برای ریختهگری منیزیم استفاده نمود، اما دستگاه ریختهگری با فشار بالا با استفاده از محفظه داغ برای منیزیم مناسب تر است زیرا سرعت کار با این دستگاه بالاتر است و به دلیل نقطه ذوب پایین منیزیم میتوان، مذاب منیزیم را در محفظههای فولادی نگه داری کرد. همانطور که در شکل مشاهده میشود با استفاده از این روش میتوان قطعات بسیار نازک با هندسه پیچیده تولید کرد.

قطعات تولید شده با روش HPDC
ریختهگری منیزیم با فشار پایین (LPC)

ریختهگری منیزیم با فشار پایین
روش ریختهگری با فشار پایین، روشی است که برای فلزات با دما ذوب پایین بسیار مناسب است، با استفاده از این روش میتوان قطعات منیزیمی عاری از هرگونه عیوب ریختهگری[۳۸] و با هندسه پیچیده تولید نمود. در شکل زیر یک دستگاه معمولی ریختهگری با فشار کم نشان داده شدهاست، در این روش میتوان از قالبهای دایمی و موقت استفاده نمود، ریختهگری شن و ماسه با فشار کم (LPSC) یا قالب ریختهگری کم فشار (LPDC) دو روش متفاوت بر اساس نوع قالب است. یک دستگاه LPC معمولاً شامل یک بوته تحت فشار شامل مذاب است که در زیر میز قالب، با یک لوله تغذیه بالابر قرار گرفتهاست که وظیفه دارد مذاب تحت فشار را به داخل قالب بالای میز، تزریق کند. از گاز خشک برای ایجاد فشار نسبتاً کم بر روی سطح مذاب منیزیم استفاده میشود. زمانی که حفره قالب از مذاب پر میشود، خود به خود فشار وارده مذاب به قطعه افزایش مییابد و باعث میشود انقباض حاصل از انجماد جبران شود. فشار خارجی پس از اتمام انجماد قطع میشود، که باعث میشود مذاب اضافی در لوله تغذیه به داخل بوته ریخته شود و همینطور قطعه از قالب خارج شود.
روشهای دیگر ریختهگری منیزیم
با این که تولید و ریختهگری قطعات منیزیم بهطور گستردهای به دلیل بهرهوری بالا و قابلیت ریختهگری عالی آلیاژهای منیزیم تحت تأثیر فرایند ریختهگری با فشار بالا قرار گرفتهاست، از روشهای ریختهگری دیگر همچون ریختهگری ثقلی، ریختهگری اسکوئیز، ریختهگری لاستفوم و تیکسومولدینگ برای ریختهگری منیزیم میتوان استفاده کرد.[۳۹][۴۰]
























آخرین دیدگاهها